
NATURE: Warum Nervenzellen schneller arbeiten als die Theorie erlaubt
Nervenzellen kommunizieren untereinander, indem sie kurze elektrische Impulse aussenden und empfangen. Seit einiger Zeit ist klar, dass die meisten dieser Signale im lebenden Gehirn unbeantwortet bleiben: In jeder Sekunde empfängt eine typische Zelle der Großhirnrinde Tausende Signale, entschließt sich aber oft weniger als ein Dutzendmal selbst einen Impuls auszusenden. Nach welchen Regeln Nervenzellen der Großhirnrinde von Säugetieren Signale verarbeiten, fand ein interdisziplinäres Team aus Forschern des Max-Planck-Instituts für Dynamik und Selbstorganisation und des Bernstein Center for Computational Neuroscience in Göttingen und Bochumer Neurophysiologen Maxim Volgushev heraus. Im Widerspruch zum zentralen Modell der Neurophysiologie (Hodgkin-Huxley-Modell) schlagen sie einen Mechanismus vor, bei dem sich Natriumkanäle in der Zellmembran gegenseitig unterstützen. Dieses Mechanismus könnte den Zellen helfen, schnellveränderliche Signale weiterzuleiten und langsame zu unterdrücken. Über ihre Funde berichten Sie in NATURE vom 20. April 2006.
Funkverkehr zwischen Nervenzellen
Jede lebende Zelle hält über ihrer Zellmembran eine elektrische Spannungsdifferenz aufrecht. Nervenzellen nutzen diese Spannungsdifferenz zum Verarbeiten und Weiterleiten von Nachrichten: Erhält eine Nervenzelle einen starken Reiz, kommt es zu einer Umkehrung der Spannung über der Zellmembran. Dieses „Aktionspotential“ breitet sich an den Zellfortsätzen der Zelle aus, an deren Ende das Signal an andere Nervenzellen übertragen wird. Wie ein solches Aktionspotential entsteht, wurde 1952 von Alan Lloyd Hodgkin und Andrew Fielding Huxley anhand von Messungen an Neuronen des Tintenfisches in einem mathematischen Modell beschrieben. Das mit dem Nobelpreis ausgezeichnete Hodgkin-Huxley-Modell dient seitdem zur Erklärung von Elektrogenese in allen Neuronen.
Lawinenartige Reaktion
Nach dem Hodgkin-Huxley-Modell wird ein Aktionspotential ausgelöst, wenn sich die elektrische Spannung über der Membran der Nervenzelle bis zu einem gewissen Schwellenwert verändert. Bestimmte Natriumkanäle werden dadurch geöffnet und lösen eine lawinenartige Reaktion aus: Durch die Kanäle strömen positiv geladene Natriumionen in die Zelle, was zur weiteren Verschiebung des Membranpotentials und der Öffnung weiterer Natriumkanäle führt. Der Schwellenwert und auch die Schnelligkeit, mit der ein Aktionspotential entsteht, variieren dabei von Zelle zu Zelle – für eine einzelne Zelle sind diese Parameter aber durch die Eigenschaften ihrer Natriumkanäle weitgehend festgelegt.
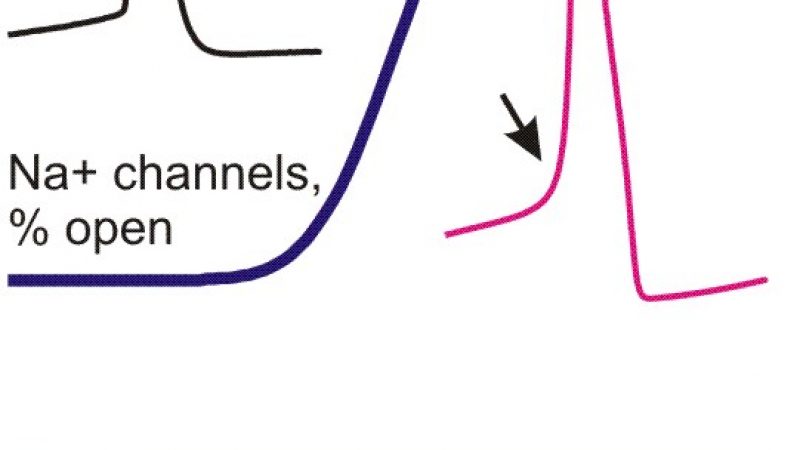
Aktionspotentiale setzen sprunghaft ein
Die Forscher haben nun die Schnelligkeit und den Schwellenwert von Aktionspotentialen in Nervenzellen der Großhirnrinde des Säugergehirns genauer untersucht. Sie konnten zeigen, dass hier Aktionspotentiale sehr sprunghaft einsetzen. Obwohl ein einzelnes Aktionspotential gut eine Millisekunde andauert, setzt ein starker Natriumeinstrom bereits in den ersten 200 Mikrosekunden ein. Die Natriumkanäle scheinen sich demnach fast gleichzeitig zu öffnen, so dass Natriumionen sehr schnell und in großen Mengen in die Zelle strömen können. Gleichzeitig aber fanden die Forscher in ihren Messungen, dass die Schwellenwerte, bei denen die Aktionspotentiale einsetzten, sehr variabel sind.
„Kooperative“ Kanäle passen nicht ins Modell
Um zu verstehen wodurch dieses ungewöhnliche Verhalten zustande kommt, versuchten sie zunächst, das Verhalten der Zellen in Computersimulationen des Hodgkin-Huxley-Modells nachzubilden. Dabei stellte sich zu ihrer Überraschung heraus, dass eine hohe Variabilität beim Schwellenwert und ein sprunghafter Anstieg des Aktionspotentials im Rahmen dieses Modells unvereinbar sind. Um das beobachtete Verhalten der Nervenzellen dennoch in Computersimulationen nachbilden zu können, postulierten die Forscher einen neuen Mechanismus, der erklärt, wie sich Natriumkanäle zwar nicht immer bei dem gleichen Schwellenwert, aber dennoch fast synchron öffnen. Öffnet sich ein Natriumkanal, so beeinflusst das nach dem neuen Modell andere Natriumkanäle in der direkten Nachbarschaft – die Kanäle öffnen „kooperativ“ und nicht, wie nach Hodgkin-Huxley, unabhängig voneinander ausschließlich in Abhängigkeit von der Spannung über der Membran. Um diese Hypothese zu testen, nutzten die Wissenschaftler einen Trick: Sie blockierten mit Tetrodoxin, dem Nervengift des japanischen Kugelfisches, einen Teil der Natriumkanäle, so dass die noch funktionsfähigen Kanäle so weit in der Membran verstreut lagen, dass sie nicht mehr kooperieren konnten. „Die in solchen Experimenten beobachteten Aktionspotentiale wiesen wie erwartet eine langsamere, mit dem Hodgkin-Huxley-Modell vereinbare Dynamik auf“, so Maxim Volgushev.
Nur schnelle Signale werden weitergegeben
In weiteren Untersuchungen konnten die Forscher zeigen, dass die Zellen diesen neuartigen Mechanismus verwenden können, um zwischen den empfangenen Signalen zu differenzieren und nur auf bestimmte zu antworten. „Die Zellen funktionieren wie ein Hochpassfilter“, fasst Bjoern Naundorf die Ergebnisse zusammen, „schnelle Signale werden gut weitergeleitet, langsame werden unterdrückt.“ Die beiden Aspekte der Aktionspotentialauslösung spielen dabei unterschiedliche Rollen. Die große Variabilität der Schwellenpotentiale ermöglicht es den Zellen, langsam einsetzende Reize zu ignorieren. Sie erhöhen dann fortlaufend ihre Schwelle, so dass in vielen Fällen gar kein Impuls ausgelöst wird. Die schnelle Auslösung der Aktionspotentiale dagegen hilft den Zellen, schnell veränderliche Signale auch mit hoher Präzision weiterzugeben. Nach dem Hodgkin-Huxley-Modell wären sie hierzu gar nicht in der Lage.
Altes Modell muss angepasst werden
„Viele Wissenschaftler – uns eingeschlossen – sahen das Hodgkin-Huxley-Modell bislang gar nicht mehr als Hypothese an, sondern glaubten, dass es im Prinzip auf alle Neurone anwendbar ist“, sagt Fred Wolf, der die Untersuchungen am Göttinger Max-Planck-Institut für Dynamik und Selbstorganisation leitete. Dem ist nicht so: Die bessere Hirnleistung von höheren Tieren wie Katzen oder auch Menschen gegenüber Tintenfischen oder Schnecken ist nach diesen Ergebnissen nicht nur auf die höhere Zahl der Neurone in den Gehirnen dieser Tiere zurückzuführen, sondern eben auch auf die Art und Weise, wie die Neurone Signale verarbeiten. Vermutlich nutzen sie dafür molekulare Mechanismen, die niederen Tieren nicht zur Verfügung stehen.
Funktion von neuronalen Systemen verstehen
„Diese Ergebnisse bringen neue Perspektiven in unsere Vorstellungen über die Funktion von Neuronen und neuronalen Systemen, und stellen damit ein breites Spektrum an offenen Fragen in unterschiedlichsten Bereichen der Neurowissenschaften“, so Maxim Volgushev. Auf welcher Stufe in der Evolution treten diese Besonderheiten von Aktionspotentialen auf? Sind sie in allen Neuronen von Säugetieren vorhanden? Was sind die molekularen Mechanismen der Kanalkooperativität, und wie wird ihre Entstehung in der Entwicklung sichergestellt? Welche weiterreichenden Konsequenzen für die Informationsverarbeitung in neuronalen Netzwerken sind damit verbunden und wie kritisch sind sie für die erfolgreiche Ausführung von allgemeinen Funktionen des Nervensystems? „Die Aufklärung dieser Fragen wird unser Verständnis des Nervensystems weiterbringen“, schätzt Volgushev.
Titelaufnahme
Naundorf, Björn, Wolf, Fred and Volgushev, Maxim. Unique features of action potential initiation in cortical neurons. In: NATURE, Vol. 440, Nr. 7087, 20. April 2006



![[Live] Magdeburg: Pressekonferenz mit Polizei und Staatsanwaltschaft](https://images-de.epochtimes.de/uploads/2024/12/THUMB-PK-Magdeburg-400x225.jpg)
























vielen Dank, dass Sie unseren Kommentar-Bereich nutzen.
Bitte verzichten Sie auf Unterstellungen, Schimpfworte, aggressive Formulierungen und Werbe-Links. Solche Kommentare werden wir nicht veröffentlichen. Dies umfasst ebenso abschweifende Kommentare, die keinen konkreten Bezug zum jeweiligen Artikel haben. Viele Kommentare waren bisher schon anregend und auf die Themen bezogen. Wir bitten Sie um eine Qualität, die den Artikeln entspricht, so haben wir alle etwas davon.
Da wir die Verantwortung für jeden veröffentlichten Kommentar tragen, geben wir Kommentare erst nach einer Prüfung frei. Je nach Aufkommen kann es deswegen zu zeitlichen Verzögerungen kommen.
Ihre Epoch Times - Redaktion